SIBUTRAMINA: En espera de una sentencia definitiva
- sáb 18 de Sep 2010
- Tema del mes
Dr Alex Valenzuela
Director Científico y Académico de la Sochob
La mayor parte de los pacientes obesos tienen dificultad para perder peso y mantener el peso perdido solo con dieta y actividad física, por lo que es necesario muchas veces la incorporación conjunta de un fármaco antiobesidad, que asegure una reducción de un 10% del peso corporal inicial, considerado éxito en términos de baja de peso.(1) No obstante lo anterior, el tratamiento farmacológico de la obesidad ha sido continuamente cuestionado, en parte por su discreta efectividad colaborativa en términos de reducción de peso y porque la mayoría de los fármacos antiobesidad inicialmente aprobados, terminan siendo retirados del mercado por sus efectos adversos, principalmente de tipo cardiovascular o psiquiátricos. Fue el caso de la fenfluramina y dextrofenfluramina, ambos retirados del mercado en 1997 por producir valvulopatía e hipertensión pulmonar(2,3), posteriormente en el 2000 y 2003, le siguió la fenilpropanolamina (4) y efedrina (5) (hemorragias intracerebrales e hipertensión arterial) y más recientemente, el 2008, fue prohibido el rimonabant, por sus efectos secundarios psiquiátricos (6). Ahora parece haberle llegado el turno a la sibutramina, siendo cuestionada por sus efectos adversos de tipo cardiovascular, proponiéndose su retiro inmediato por parte de la European Medicines Agency, EMEA (Agencia Europea de Medicamentos) (7).
La sibutramina actualmente es uno de los fármacos antiobesidad más utilizado en muchos países del mundo, aprobado por la FDA en 1997, logró rápidamente posesionarse como una de las principales drogas para combatir la obesidad en los adultos, estando disponible en más de 80 países y siendo prescrita a más de 16 millones de personas. Los resultados del estudio STORM (Sibutramine Trial of Obesity Reduction and Maintenance) (8) contribuyeron enormemente a ello, ya que mostró que la administración de sibutramina durante 2 años de manera continua (Figura 1), a un grupo de más de 600 sujetos obesos, producía una pérdida significativa de peso corporal con mantención de él a través del tiempo de uso, además de reducción de algunos factores de riesgo cardiovascular asociados (colesterol, triglicéridos, insulina y ácido úrico).
Figura 1
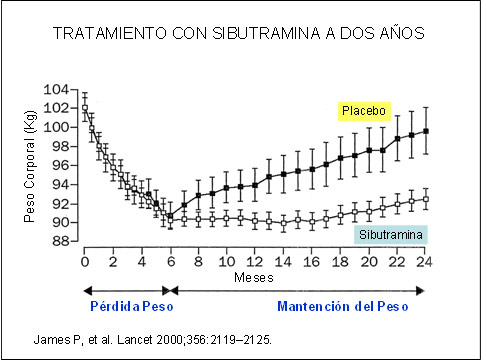
Su efecto antiobesidad está determinado especialmente por su capacidad de inhibir la ingesta alimentaria, al potenciar la saciedad (sacietógeno), aunque también incrementa el gasto energético, vía inhibición de la recaptación de serotonina y noradrenalina cerebral (y en mucho menor escala también dopamina), incrementando las concentraciones cerebrales de estos neurotransmisores. Gran parte de sus acciones antiobesidad están mediadas por sus 2 metabolitos activos, M1 y M2, generados por el metabolismo hepático de la sibutramina, teniendo una vida media prolongada, lo que hace que se administre una vez al día y que su efectos anorexígenos duren alrededor de 16 horas (9).
Su utilización como fármaco antiobesidad no ha estado exenta de controversias, particularmente por sus efectos adversos de tipo cardiovascular, reportándose incrementos de la presión arterial y frecuencia cardíaca (2 a 3 mmHg y 3 a 7 latidos por minuto) (10), lo que ha llevado a estar restringida o contraindicada en aquellos pacientes obesos con enfermedad cardiovascular, como son los hipertensos mal controlados y aquellos con arritmias y antecedentes de infarto miocárdico o accidente cerebrovascular. Es importante destacar que la sibutramina, ha mostrado ser en general segura en pacientes hipertensos bien controlados, incluso por períodos tan prolongados como por 1 año, por lo cual no está contraindicada en éstos (11,12,13).
Como todo fármaco antiobesidad, la administración de sibutramina debe ajustarse estrictamente a las condiciones de uso actualmente autorizadas, esto es: administrada bajo supervisión médica, no tener contraindicación farmacológica, formando parte integral del tratamiento de la obesidad y sólo en aquellos pacientes que presenten obesidad, definida por un índice de masa corporal ≥ 30 kg/m2 y/o un sobrepeso ≥ 27 kg/m2 asociado a patologías (hipertensión arterial, diabetes, dislipidemia, apnea del sueño, etc) (14) .
Esta semana (21/01/2010) la EMEA, basados en los resultados preliminares del estudio SCOUT (Sibutramine Cardiovascular OUTcome Trial, en inglés), iniciado el 2002 (15), decidió recomendar el retiro de la sibutramina en los países de la Unión Europea, aduciendo que los riesgos cardiovasculares del fármaco son superiores a los beneficios que aporta, lo que ha hecho que ya algunos países estén prohibiendo su venta, pese a que en julio del 2002, la EMEA había reconfirmado la relación favorable riesgo-beneficio de la sibutramina, por lo que no aconsejó su retirada. Si bien, en el estudio SCOUT los pacientes tenían enfermedad cardiovascular y por ende de alto riesgo, la EMEA señaló que los pacientes obesos y con sobrepeso deben ser considerados de alto riesgo cardiovascular.
El estudio SCOUT, justamente fue realizado con la finalidad de observar el impacto del tratamiento a largo plazo (6 años) con sibutramina 10 a 15 mg/día sobre el riesgo cardiovascular, en más de 10.000 pacientes obesos o con sobrepeso, mayores de 55 años y con al menos un factor de riesgo adicional para enfermedad cardiovascular (enfermedad arterial coronaria, cerebral o periférica, hipertensión arterial controlada, insuficiencia cardiaca grado I a II o diabetes tipo 2) (15). De acuerdo a los resultados preliminares dados a conocer recientemente, se observó un mayor incremento de eventos cardiovasculares graves (tales como infarto o accidente cerebrovascular) en los pacientes tratados con sibutramina con respecto a los que se les administró placebo (11,4% versus 10%). Cabe señalar que el estudio SCOUT se realizó en pacientes con un riesgo cardiovascular elevado, en quienes normalmente la administración de sibutramina estaba contraindicada.
Por su parte la FDA, en un reporte dado a conocer en noviembre de 2009 (16), señala con respecto a los hallazgos del SCOUT, que la sibutramina debería evitarse en pacientes con historia de enfermedad arterial coronaria, falla cardiaca congestiva, arritmias o accidente cerebrovascular, es decir las mismas contraindicaciones actualmente en uso para ella, agregando que se debe evaluar de manera personalizada los riesgos y beneficios con su administración, además de comprometerse a realizar una revisión más completa de la sibutramina. Posteriormente, esta semana (21/01/2010), la FDA en un segundo comunicado (17), notifica a los profesionales de la salud que una revisión adicional de datos, muestra un incremento en el riesgo de infarto miocárdico y accidente cerebrovascular en pacientes con historia de enfermedad cardiovascular que están con sibutratamina, por lo que insta a los fabricantes a agregar una nueva contraindicación, la cual señala que no debe emplearse en sujetos con historia de enfermedad cardiovascular, incluyendo:
• Historia de enfermedad coronaria (Ej: angina, infarto)
• Historia de arritmia cardiaca
• Historia de falla cardiaca congestiva
• Historia de enfermedad arterial periférica
• Hipertensión no controlada (Ej: > 145/90 mmHg)
Igualmente sugiere que los pacientes que estén con sibutramina tomen contacto con sus médicos, para discutir si el uso de esta es apropiado y si deben continuar tomándola.
Finalmente, la recomendación hecha por la EMEA ha sido remitida a la Comisión Europea (CE), que será la encargada de tomar una decisión definitiva sobre el mantenimiento del fármaco en el mercado. Normalmente, la CE sigue las indicaciones de la Agencia Europea de Medicamentos.
En conclusión, en este momento existe divergencia en cuanto a la posición que adoptan ambas entidades reguladoras de fármacos con respecto a la sibutramina (algo que también ocurrió con el rimonabant), la EMEA exige el retiro del fármaco, mientras que la FDA adopta una posición menos drástica, tomar una mayor precaución con su uso, quedando prohibida en pacientes con antecedentes de enfermedad cardiovascular. Por tanto, hasta que no esté dicha la última palabra, es conveniente extremar las medidas del uso de sibutramina en los pacientes obesos o con sobrepeso, junto con evaluar adecuadamente riesgos versus beneficios de manera personalizada, de tal forma de disminuir al máximo el riesgo de presentar algún evento cardiovascular.
Referencias
1.- Wadden TA, Foster GD. Behavioral treatment of obesity. Med Clin North Am 2000;84:441-461.
2.- Connolly HM, Crary JL, McGoon MD, et al. Valvular heart disease associated with fenfluramine-phentermine. N Engl J Med 1997;337:581–588.
3.-http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationfor PatientsandProviders/ucm179871.htm
4.- Kernan WN, Viscoli CM, Brass LM, et al. Phenylpropanolamine and the risk of hemorrhagic stroke. N Engl J Med 2000;343:1826–1832.
5.- Haller CA, Benowitz NL. Adverse cardiovascular and central nervous system events associated with dietary supplements containing ephedra alkaloids. N Engl J Med 2000;343:1833-1838.
6.- Mitchell P, Morris M. Depression and anxiety with rimonabant. Lancet 2007;370:1671-1672.
7.- http://www.ema.europa.eu/
8.- James WPT, Astrup A, Finer N, Hilsted J, Kopelman P, Rössner S, Saris WHM, Van Gaal LF, for the STORM Study Group. Effects of sibutramine on weight maintenance after weight loss: a randomized trial. Lancet 2000;356:2119–2125.
9.- Luque C, Rey J. The discovery and status of sibutramine as an anti-obesity drug. European Journal of Pharmacology 2002;440;119-128.
10.- Sharma AM. Does pharmacologically induced weight loss improve cardiovascular outcome? Sibutramine pharmacology and the cardiovascular system. Eur Heart J 2005;7(Suppl).L:L39–L43.
11.- Hazenberg BP. Randomized, double-blind, placebo-controlled, multicenter study of sibutramine in obese hypertensive patients. Cardiology 2000;94:152–158.
12.- McMahon FG, Fujioka K, Singh BN, et al. Efficacy and safety of sibutramine in obese white and African American patients with hypertension: a 1-year, double-blind, placebo-controlled, multicenter trial. Arch Intern Med 2000;160:2185–2191.
13.- McMahon FG, Weinstein SP, Rowe E, et al. Sibutramine is safe and effective for weight loss in obese patients whose hypertension is well controlled with angiotensin-converting enzyme inhibitors. J Hum Hypertens 2002;16:5–11.
14.- National Heart, Lung, and Blood Institute Obesity Education Initiative, Clinical guidelines on the identification, evaluation, and treatment of overweight and obesity in adults: the evidence report, US Department of Health and Human Services, Bethesda, MD (1998).
15.- James WPT. The SCOUT study: risk-benefit profile of sibutramine in overweight high risk cardiovascular patients. Eur Heart J Suppl 2005;7:L44–48.
16.- Early Communication about an Ongoing Safety Review of Meridia (sibutramine hydrochloride).http://www.fda.gov/Drugs/DrugSafety/Postmarket DrugSafetyInformationforPatientsandProviders/DrugSafetyInformationforHeathcareProfessionals/ucm191650.htm.
17.http://www.fda.gov/Safety/MedWatch/SafetyInformation/SafetyAlertsfor Human MedicalProducts/ucm198221.htm
Artículos Anteriores
Rigidez Arterial y Riesgo Vascular
Obesidad: Una mirada más allá de la sobrealimentación y el sedentarismo.
Visfatina: Una puesta al día
Diabetes e Hipogonadismo Hipogonadotrófico
