TRASPLANTE DE MICROBIOTA FECAL Y OBESIDAD
- mar 2 de Feb 2016
- Tema del mes
TEMA DEL MES: Febrero 2016
Dr. Alex Valenzuela Montero
Presidente Sociedad Chilena de Obesidad
Docente de la carrera de Nutrición y Dietética de las Universidades del Desarrollo y Mayor
La microbiota intestinal puede definirse como el conjunto de microorganismos vivos que cohabitan en el tubo gastrointestinal, algunos haciéndolo de manera permanente y otros transitoriamente. Se calcula que la diversidad de bacterias intestinales alcanza entre 500 a 1.000 especies en el ser humano, siendo su número tan abundante que existen 10 veces más bacterias que células humanas, llegando a pesar entre 1 kg a 1,5 kg (1). Las bacterias de la microbiota intestinal pueden agruparse en cuatro fila: Firmicutes, Bacteroidetes, Actinobacteria y Proteobacteria, con un predomino de las dos primeras (aproximadamente un 90%) (2).
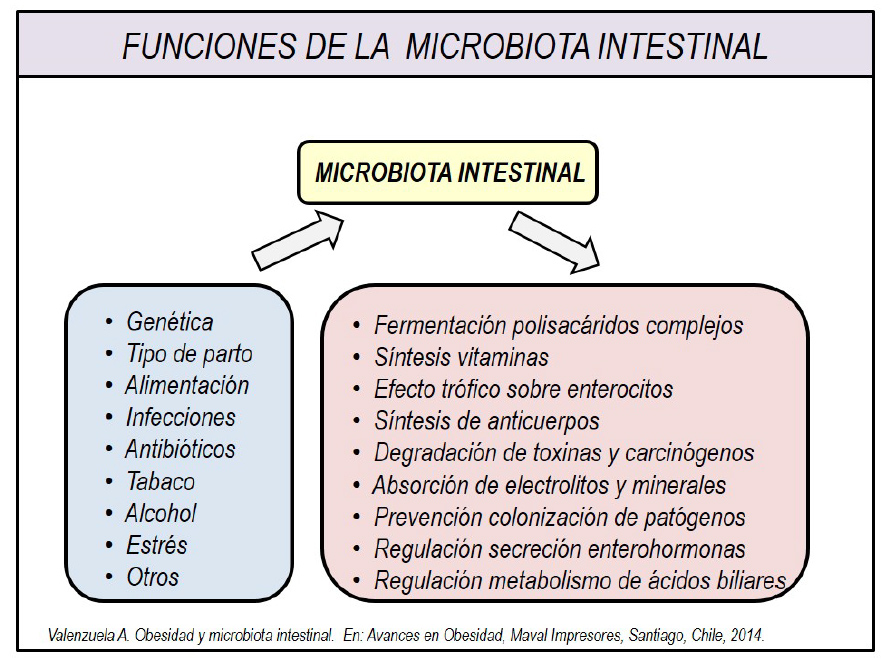
La microbiota intestinal tiene importantes funciones biológicas, predisponiendo su alteración (disbiosis) a diversas enfermedades (Figura 1), por lo que la búsqueda de su normalización ha llegado a ser prioritaria para la prevención y potencial tratamiento de diversas patologías intestinales y extraintestinales. El trasplante de microbiota fecal como un método del restablecimiento de esta, ha llegado a ser una de las técnicas más investigadas en el último tiempo.
Figura 1(3)
El trasplante de microbiota fecal (TMF), también conocido como bacterioterapia fecal, consiste en traspasar heces de un donante sano previamente seleccionado a uno enfermo, con la finalidad de restablecer la microbiota intestinal normal en este último. Si bien, existen reportes muy antiguos de su existencia para tratar especialmente cuadros diarreicos, no fue solo hasta unos años atrás donde esta técnica se generalizó, particularmente para el tratamiento de infecciones severas o resistentes ocasionadas por Clostridium difficile (4,5,6).
También hay reportes anecdóticos que señalan que el TMF pudiera servir como tratamiento para otras patologías intestinales y extraintestinales, tales como: síndrome de intestino irritable, enfermedad inflamatoria intestinal, autismo, constipación, fatiga crónica, algunos trastornos neurológicos y síndrome metabólico (7). A esta larga lista de potenciales aplicaciones del TMF, ahora último se suma la posibilidad de que pudiera ser empleada en el tratamiento de la obesidad, ello basado en la importancia que tiene la microbiota intestinal en la regulación del metabolismo energético.
Por lo general el TMF es un procedimiento seguro y no reviste mayores inconvenientes, como tampoco se observan efectos adversos de importancia, siendo estos infrecuentes y transitorios, reportándose en algunos casos: meteorismo, flatulencia, constipación y molestias abdominales y anales (8).
Entre los principales temores del TMF, está el hecho que las heces contienen una gran cantidad de bacterias y virus no identificados aún que podrían ser patógenos para el receptor. Por otra parte, existe insuficiente información con respecto a los efectos a largo plazo del TMF, especialmente en lo que concierne a la transferencia de tumorogénesis o enfermedades autoinmunes, metabólicas y psiquiátricas (9). Por todo lo anterior, se está trabajando en la posibilidad de crear una comunidad bacteriana definida, que reemplace al TMF (10).
También existe preocupación en cuanto a la selección de los donantes, particularmente con los exámenes de sangre y heces a solicitar, existiendo diferencias entre las instituciones que realizan el TMF.
Técnica
El procedimiento más habitual para el tratamiento de la diarrea por C. difficile consiste en tomar una porción de heces del donante, la cual varía entre 50 g a 150 g, mezclarla con suero fisiológico y centrifugarla en una juguera. Posteriormente el homogenizado es filtrado varias veces para retirar las partículas grandes y la parte líquida queda así lista para ser administrada al tracto gastrointestinal del paciente mediante diferentes modalidades, a saber: colonoscopia, endoscopia, sonda nasoduodenal o enema y ahora último a través de capsulas orales (11,12). En Europa la sonda nasoduodenal es el método más empleado, mientras que EEUU y Canadá es la colonoscopia/endoscopia o simplemente el kit de enema.
La cantidad infundida de solución de heces fresca o refrigerada en un TMF es altamente variable, no existiendo completo consenso al respecto, dependiendo en parte de la ruta de administración, siendo habitualmente entre 250 a 500 ml o incluso más, permitiendo la utilización de mayores cantidades a través de colonoscopia (13). La infusión se realiza a través de jeringas conteniendo 20 ml a 50 ml de la suspensión filtrada de heces, en un tiempo de alrededor de 2 horas.
Bancos de heces
Históricamente los donantes de heces han sido esposos, familiares o amigos del enfermo. Sin embargo, cada vez es más frecuente observar que el donante no guarda ninguna relación con el receptor, recibiendo este último las heces congeladas desde un banco de heces, previa selección exhaustiva del donante.
Los sujetos candidatos a ser donantes de heces son seleccionados mediante un proceso muy riguroso, que incluye en algunos laboratorios una serie de análisis de sangre y heces para descartar infecciones virales, bacterianas y parasitarias, contestar un cuestionario de alrededor de 100 preguntas (similares a los realizados para donar sangre) y tener un peso normal. No califican como donantes: los obesos, aquellos que han tomado antibióticos los últimos 6 meses, quienes hayan viajado a lugares exóticos en el último tiempo y tengan tatuajes recientes o padezcan enfermedades infecciosas.
Empresas especializadas en la recolección y almacenamiento de heces como Open Biome, EEUU, señalan que solo el 3% de los candidatos a donantes son aceptados, a los cuales se les facilita los contenedores para depositar las donaciones, que deben ser procesadas en menos de dos horas, recibiendo a cambió una cancelación de $ 40 dólares por vez, pudiendo obtener $250 dólares semanales. Por otra parte, la misma empresa comercializa a $ 250 dólares la dosis para TMF a más de 200 instituciones (14).
Las heces recolectadas son filtradas a través de un tamiz con ayuda de unas prensas, separando la parte sólida de la líquida, siendo está ultima fracción la que es envasada y mantenida a 80 ºC bajo cero, hasta su posterior utilización, donde las bacterias vuelven a la vida a temperatura ambiental.
Trasplante de microbiota fecal en humanos
La mayor experiencia con TMF humana deriva de los tratamientos experimentales de personas con cuadros diarreicos ocasionados por C.difficile. Este nuevo procedimiento ha sido aprobado ya por algunas entidades científicas como una alternativa de tratamiento no farmacológico para la colitis por C.difficile severa o recurrente, particularmente en aquellos sujetos no respondedores a las medidas habituales (antibioticoterapia, probióticos, lavado intestinal) (15). La curación de la infección por C.difficile posterior al TMF puede alcanzar a un 94% de los pacientes, comparada al 31% lograda con antibióticos (16).
Solo en los EEUU se hospitalizan anualmente alrededor de 250.000 personas por diarreas ocasionadas por C. difficile, ocasionando unas 14.000 muertes (17).
Transmisión de la obesidad o delgadez vía trasplante de microbiota fecal
Numerosas líneas de investigación, particularmente en modelos de roedores, sugieren que la microbiota intestinal está involucrada en el desarrollo de la obesidad. Un buen ejemplo de lo anterior, está dado por el rápido crecimiento y desarrollo que logran los animales y aves expuestos a dosis subterapéuticas de antibióticos, una práctica muy difundida y conocida por los ganaderos desde la década del sesenta (18). De igual modo, lo mismo se ha descrito con el uso temprano de antibióticos en niños, especialmente en el primer año de vida, predisponiendo a ganancias de peso corporal en el futuro (19,20).
Los mecanismos implicados son parcialmente comprendidos, postulándose que la microbiota intestinal produciría diversas enzimas que permitirían una mayor extracción de las calorías contenidas en los alimentos, particularmente de las fibras (polisacaráridos complejos que son indigeribles por los jugos digestivos), generando monosacáridos y ácidos grasos de cadena corta, que son absorbidos y almacenados como grasa, además de reducir la oxidación de ácidos grasos (21,22) (Figura 2). Se estima que alrededor de un 10% de las calorías requeridas diariamente en los humanos son aportadas por los ácidos grasos de cadena corta (23).
Ratones sin microbiota intestinal (denominados ratones axénicos), son más delgados y poseen menos grasa corporal que aquellos con su microbiota intestinal intacta, a pesar de ingerir mayores cantidades de alimentos. La introducción mediante trasplante fecal de su microbiota intestinal habitual, hace que estos incrementen rápidamente de peso y grasa corporal (24,25).
Por otra parte, ratones axénicos a los cuales se les realiza una transferencia de heces a través de un trasplante fecal proveniente de ratones delgados u obesos, hace que estos adquieran el fenotipo del donante (24). Es decir si el donante es delgado, los ratones serán delgados, pero si es obeso, adquirirán el fenotipo obeso, lo que certifica la importancia que tiene la microbiota intestinal en el desarrollo y/o mantención de la obesidad.
Experimentos con heces humanas trasplantadas a ratones axénicos también han sido hechas, con similares resultados, es decir estos adquieren el fenotipo del donante, obesidad o normalidad en su peso corporal (26).
También es interesante señalar que la transferencia de microbiota intestinal de un ratón con bypass gástrico a ratones axénicos no operados, produce reducción de peso y grasa corporal en estos últimos (27).
Figura 2
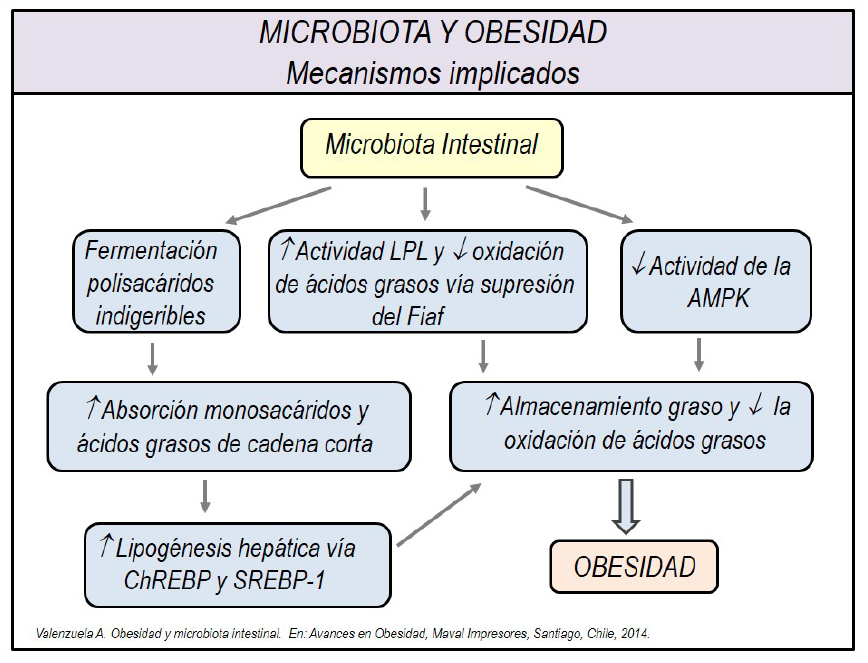
Microbiota intestinal y contribución al desarrollo de la obesidad. A través de múltiples mecanismos la microbiota intestinal favorece la ganancia de peso corporal, pudiendo contribuir al desarrollo de obesidad en personas susceptibles genéticamente. Una extracción más eficiente de la energía contenida en las fibras dietarias (monosacáridos y ácidos grasos de cadena corta), un incremento en la lipogénesis hepática y una reducción de la oxidación de ácidos grasos, están dentro de los principales mecanismos que promueven la expansión grasa.
LPL: lipoproteinlipasa; Fiaf: Factor adipocitario inducido por el ayuno; ChREBP: Proteína de unión al elemento de respuesta a carbohidratos; SREBP-1: Proteína de unión al elemento de respuesta a esteroles-1; AMPK: Proteína quinasa activada por el AMP.
Transmisión de la obesidad humana vía trasplante de microbiota fecal de hija a madre
Existe un reporte (28) en el cual una mujer de 32 años, con un IMC 26 kg/m2, experimentó una excesiva ganancia de peso corporal llegando a desarrollar obesidad, después de realizarse un TMF debido a una infección por C. difficile refractaria a los tratamientos convencionales. La donante de las heces fue su hija de 16 años, que al momento de la donación tenía un IMC 26,4 kg/m2.
La madre después de recibir el TMF curó de su infección, pero después de 16 meses del trasplante fecal, muestra un incremento de peso corporal involuntario de aproximadamente 15 kg, que siguió aumentando por otros 3 kg más a los 36 meses, alcanzando un IMC 34,5 kg/m2, a pesar de los intentos para no subir de peso. En el intertanto su hija incrementó 13 kg de peso corporal (28).
Este único reporte nos muestra que teóricamente es posible transmitir la obesidad humana a través de la microbiota intestinal, no obstante, se requieren mayores investigaciones para asegurarlo. De todas maneras, se está siendo muy cuidadoso en la selección de los donantes de heces, no solo en que sean saludables si no también en que tengan un peso normal estable.
Trasplante fecal de microbiota como una opción de tratamiento de la obesidad y sus comorbilidades
La obesidad animal y humana se acompaña de alteraciones en la microbiota intestinal, tanto en la diversidad como en la proporción de microorganismos que la componen, reportando la mayoría de los estudios un aumento importante de los firmicutes con una disminución significativa de los bacteroidetes (29,30). Esta disbiosis contribuye a ser más eficiente en la extracción, gasto y almacenamiento de las calorías ingeridas en los alimentos, promoviendo el desarrollo y mantención de la obesidad (24,25). Por tanto, el restablecimiento de la microbiota intestinal a través de prebióticos, probióticos, simbióticos, antibióticos y trasplante fecal de microbiota, es una opción terapéutica teóricamente válida para el tratamiento de la obesidad humana y sus comorbilidades (31).
En el campo de la obesidad y enfermedades metabólicas, si bien el TMF se ve como una alternativa teóricamente viable de tratamiento, no existen trabajos definitivos que así lo demuestren.
Solo existe un estudio (32) en el cual a un grupo de hombres obesos caucásicos con síndrome metabólico, se les hizo un TMF mediante gastroduodenoscopía, con heces provenientes de donantes sanos (IMC < 23 kg/m2), con la finalidad de evaluar la insulinosensibilidad después de 6 semanas posterior al trasplante a través de un clamp euglicémico hiperinsulinémico, observándose un incremento de esta a las 6 semanas.
Se está programando un estudio de 12 semanas de duración en un grupo de 14 sujetos obesos (mas 7 que recibirán solo placebo), de entre 25 y 60 años, para evaluar la efectividad del TMF, en términos de reducción del peso corporal y mejoría de la composición corporal e insulinosensibilidad (33). La vía de administración será oral, a través de cápsulas resistentes al ácido estomacal que contienen heces deshidratadas refrigeradas (entre 1 a 2 g por cada una), sin olor ni sabor.
Todos los participantes seguirán con su estilo de vida normal, no se les indicará ningún tipo de actividad física ni dieta especial. Los donantes son sujetos sanos, de peso normal, previamente seleccionados.
Identificando las bacterias de la obesidad y la delgadez
Investigaciones en heces animales y humanos han permitido ir conociendo algunas bacterias que están íntimamente asociadas a la obesidad y a la delgadez (Tabla 1), lo que permite especular que en un futuro próximo será posible incorporar selectivamente grupos de bacterias con el propósito específico de modificar el peso corporal y/o tratar sus comorbilidades.
Tabla 1
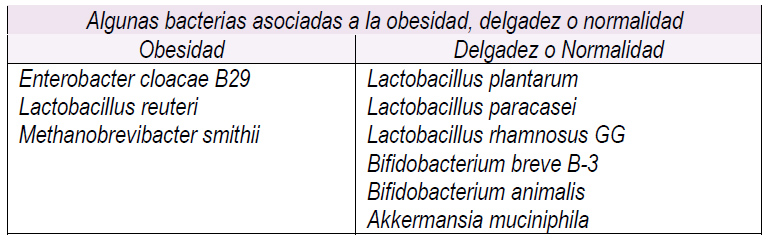
Dentro de las bacterias que ahora último han centrado la investigación está la Akkermansia muciniphila (perteneciente a las Verrucomicrobia), una bacteria que habita normalmente en la capa de mucus intestinal, representando entre el 3% a 5% de la comunidad bacteriana en sujetos saludables y que se encuentra disminuida en la obesidad y diabetes tipo 2 (33,34). Esta bacteria se correlaciona inversamente con el peso corporal en humanos y roedores y parece desempeñar un rol clave en la permeabilidad intestinal y por ende en la inflamación metabólica (endotoxemia metabólica), al regular el paso de lipopolisacáridos desde el intestino hacia la circulación (35).
La administración de prebióticos (oligofructosa) a ratones alimentados con una dieta hipergrasa, permite restaurar las concentraciones de A.muciniphila, evidenciándose una reversión de los trastornos metabólicos asociados a esta dieta, incluyendo reducción de la masa grasa, endotoxemia metabólica, inflamación del tejido adiposo e insulinorresistencia (36). Semejantes resultados se observan en ratones con la administración directa de A.muciniphila en los alimentos (36).
Es interesante destacar que la metformina también incrementa la población de A.muciniphila, no descartándose que parte de sus acciones antidiabéticas estén determinadas por este cambio en la microbiota intestinal (37).
Recientemente también se ha podido determinar en ratones que la ingesta de aceite de pescado durante 11 semanas, promueve el crecimiento de A. muciniphila (38). Contrariamente la exposición al frío a -6 ºC a ratones durante 10 días reduce la cantidad de esta bacteria, permitiendo su ausencia una adaptación intestinal que permite una mayor extracción de calorías intestinales para hacer frente a las mayores demandas energéticas que impone el frío (39).
Estos experimentos sugieren que es posible tratar la obesidad y sus comorbilidades a través de la administración de poblaciones bacterianas intestinales específicas que presenten funciones metabólicas, como es el caso de la A. muciniphila.
Helicobacter Pylori y ganancia de peso corporal
Existe una asociación inversa entre la prevalencia de Helicobacter pylori y sobrepeso u obesidad en muchos países, lo cual es concordante con lo señalado por varios estudios (40). En efecto, muchas investigaciones realizadas en niños y adultos señalan que la erradicación del H. Pylori en humanos se acompaña de una ganancia progresiva de peso corporal (41). En un estudio a 6 meses, se observó que la erradicación de H. pylori se asoció a un incremento de 3 kg de peso corporal en comparación al placebo (41).
El mecanismo se desconoce, pero se sospecha que podría ser principalmente vía incremento de la hormona ghrelina, dado que su eliminación gástrica se asocia a un aumento de sus niveles circulantes, promoviendo la ingesta alimentaria (42). Es decir, pareciera ser que el H. pylori en condiciones normales controla la secreción gástrica de ghrelina, aunque no se descarta que también regule la producción de leptina, que en algunos estudios aparece disminuida después de su eliminación (43).
Otras explicaciones propuestas para la asociación inversa entre H. pylori y obesidad, sería que su erradicación promovería una mayor ingesta de alimentos al mejorar los síntomas dispépticos o bien que los mismos mecanismos que favorecen la colonización gástrica tengan a su vez acciones protectores para el desarrollo de obesidad, como puede ser por ejemplo a través de efectos sobre el microbioma gastrointestinal (44).
Referencias
1.- Bäckhed F, Ley RE, Sonnenburg JL, et al. Host-bacterial mutualism in the human intestine. Science 2005;307:1915-1920.
2.- Draganov PV. Recent advances and remaining gaps in our knowledge of associations between gut microbiota and human health. World J Gastroenterol 2009;15:81-85.
3.- Valenzuela A. Obesidad y microbiota intestinal. En: Actualización en obesidad. Maval Impresores, Santiago, Chile 2014.
4.- Zhang F, Luo W, Shi Y, et al. Should we standardize the 1700-year-old-fecal microbiota transplantation? Am J Gastroenterol 2012;107:1755.
5.- Eiseman B, Silen W, Bascom G, et al. Fecal enema as an adjunct in the treatment of pseudomembranous enterocolitis. Surgery 1958;44:854-859.
6.- Schwan A, Sjolin S, Trottestam U, et al. Relapsing Clostridium difficile enterocolitis cured by rectal infusion of homologous faeces. Lancet 1983;2:845.
7.- Borody TJ , Khoruts A. Fecal microbiota transplantation and emerging applications. Nat Rev Gastroenterol Hepatol 2011;9:88-96.
8.- Borody TJ, Peattie D, Kapur A. Could fecal microbiota transplantation cure all Clostridium difficile infections? Future Med Ltd 2014;9:1-3.
9.- Kump PK, Krause R, Allerberger F, et al. Faecal microbiota transplantation—the Austrian approach. Clin Microbiol Infect 2014;20:1106-1111.
10.- Koenigsknechta MJ, Young VB. Faecal microbiota transplantation for the treatment of recurrent Clostridium difficile infection: current promise and future needs. Curr Opin Gastroenterol 2013;29:628-632.
11.- Cammarota G, Ianiro G, Gasbarrini A. Fecal microbiota transplantation for the treatment of Clostridium difficile infection: a systematic review. J Clin Gastroenterol 2014;48:693-702.
12.- Borody TJ, Brandt LJ, Paramsothy S, Agrawal G. Fecal microbiota transplantation: a new standard treatment option for Clostridium difficile infection. Expert Rev Anti Infect Ther 2013;11:447-449.
13.- Brandt LJ, Aroniadis OC. An overview of fecal microbiota transplantation: techniques, indications, and outcomes. Gastrointest Endosc 2013;78:240-249.
14.- Kelly CR, Kahn S, Kashyap P, et al. Update on fecal microbiota transplantation 2015: indications, methodologies, mechanisms, and outlook. Gastroenterology 2015;149:223-237.
15.- van Nood E, Speelman P, Nieuwdorp M, et al. Fecal microbiota transplantation: facts and controversies. Curr Opin Gastroenterol 2014;30:34-39.
16.- van Nood E, Vrieze A, Nieuwdorp M, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med 2013;368:407-415.
17.- Leffler DA, Lamont JT. Clostridium difficile infection. N Engl J Med 2015;372:1539-1548.
18.- Lassiter C. Antibiotics as growth stimulant for dairy cattle: a review. J Dairy Sci 1955;38:1102–1138.
19.- Cox LM, Blaser MJ. Antibiotics in early life and obesity. Nat Rev Endocrinol 2015;11:182-190.
20.- Trasande L, Blustein J, Liu M, Corwin E, et al. Infant antibiotic exposures and early-life body mass. Int J Obes 2013;37:16-23.
21.- Walker AW, Parkhill J. Microbiology. Fighting obesity with bacteria. Science 2013;341:1069-1070.
22.- Cox LM, Blaser MJ. Pathways in microbe-induced obesity. Cell Metab 2013;17:883-894.
23.- Bergman EN. Energy contributions of volatile fatty-acids from the gastrointestinal-tract in various species. Physiol Rev 1990;70:567-590.
24.- Turnbaugh PJ, Ley RE, Mahowald MA, et al. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature 2006;444:1027-1031.
25.- Backhead F, Ding H, Wang T, et al. The gut microbiota as an environmental factor that regulates fat-storage. Proc Natl Acad Sci USA 2004;101:15718– 157123.
26.- Ridaura VK, Faith JJ, Rey FE, et al. Gut microbiota from twins discordant for obesity modulate metabolism in mice. Science 2013;341:1241214.
27.- Liou, AP, Paziuk M, Luevano JM Jr, et al. Conserved shifts in the gut microbiota due to gastric by pass reduce host weight and adiposity. Sci Transl Med. 2013 Mar 27;5(178):178ra41.
28.- Alang N, Kelly CR. Weight gain after fecal microbiota transplantation. Open Forum Infect Dis 2015;2:ofv004.
29.- Ley RE, Bäckhed F, Turnbaugh P, et al. Obesity alters gut microbial ecology. Proc Natl Acad Sci U S A 2005;102:11070-11075.
30.- Ley RE, Turnbaugh PJ, Klein S, et al. Microbial ecology: human gut microbes associated with obesity. Nature 2006;444:1022-1023.
31.- Kootte RS, Vrieze A, Holleman F, et al.The therapeutic potential of manipulating gut microbiota in obesity and type 2 diabetes mellitus. Diabetes Obes Metab 2012;14:112-120.
32.- Vrieze A, Van Nood E, Holleman F, et al. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology 2012;143:913-916.
33.- Yu E. Fecal microbiota transplant for obesity and metabolism. https://clinicaltrials.gov/ct2/show/study/NCT02530385
33.- Derrien M, Vaughan EE, Plugge CM, et al. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium. Int J Syst Evol Microbiol 2004;54:1469-1476.
34.- Santacruz A, Collado MC, García-Valdés L, et al. Gut microbiota composition is associated with body weight, weight gain and biochemical parameters in pregnant women. Br J Nutr 2010;104:83-92.
35.- Collado MC, Isolauri E, Laitinen K, et al. Distinct composition of gut microbiota during pregnancy in overweight and normal-weight women. Am J Clin Nutr 2008;88:894-899.
36.- Everard A, Belzer C, Geurts L, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet induced obesity. Proc Natl Acad Sci USA 2013;110:9066-9071.
37.- Shin N-R, Lee J-C, Lee H-Y, et al. An increase in the Akkermansia spp. population induced by metformin treatment improves glucose homeostasis in diet-induced obese mice. Gut 2014;63:727-735.
38.- Caesar R, Tremaroli V, Kovatcheva-Datchary P, et al. Crosstalk between gut microbiota and dietary lipids aggravates wat inflammation through TLR signaling. Cell Metab 2015;2:658-668.
39.- Chevalier C, Stojanović O, Colin DJ, et al. Gut microbiota orchestrates energy homeostasis during cold. Cell 2015;163:1360-1374.
40.- Lender N, Talley NJ, Enck P, et al. Review Article: Associations between Helicobacter Pylori and Obesity- -An Ecological Study. Aliment Pharmacol Ther 2014;40:24-31.
41.- Lane JA, Murray LJ, Harvey IM, et al. Randomised clinical trial: Helicobacter pylori eradication is associated with a significantly increased body mass index in a placebo-controlled study. Aliment Pharmacol Ther 2011;33:922-929.
42.- Nwokolo CU, Freshwater DA, O’Hare P, et al. Plasma ghrelin following cure of Helicobacter pylori. Gut 2003;52:637-640.
43.- Francois F, Roper J, Joseph N, et al. The effect of H. pylori eradication on meal-associated changes in plasma ghrelin and leptin. BMC Gastroenterol 2011;11:37.
44.- Moayyedi P, Soo S, Deeks J, et al. Eradication of Helicobacter pylori for non-ulcer dyspepsia. Cochrane Database Syst Rev. 2005. p. CD002096.
Articulos Anteriores
CONTRAVE: la nueva esperanza farmacológica para la obesidad
LORCASERIN : ¿una esperanza menos?
SIBUTRAMINA: En espera de una sentencia definitiva
Rigidez Arterial y Riesgo Vascular
Obesidad: Una mirada más allá de la sobrealimentación y el sedentarismo.
Visfatina: Una puesta al día
Diabetes e Hipogonadismo Hipogonadotrófico
