CONTRAVE: la nueva esperanza farmacológica para la obesidad
- dom 12 de Dic 2010
- Tema del mes
Dr. Alex Valenzuela M
Director Científico y Académico de la Sociedad Chilena de Obesidad
Director Académico de la Federación Latinoamericana de Sociedades de Obesidad (FLASO)
El control de la ingesta alimentaria es un proceso altamente complejo, que involucra múltiples señales de tipo hormonales, metabólicas y neuronales, provenientes de la periferia que informan continuamente a los centros hipotalámicos de nuestro estado energético y cambios en el peso corporal. Así, desde un punto de vista evolutivo, estamos mejor preparados para defendernos más eficientemente contra la carencia de alimentos que contra la abundancia, lo que determina que ganemos más fácilmente peso y que nos sea más difícil bajar, existiendo para ello múltiples vías informativas (redundancia) que nos defienden contra la desnutrición (1,2).
La reducción de peso corporal por medios no quirúrgicos, alcanza por lo general una estabilización cuando se pierde alrededor del 10% a 15% del peso corporal inicial, en parte gracias a diferentes mecanismos que acomodan nuestros egresos calóricos (metabolismo basal, termogénesis inducida por la dieta y actividad física) a nuestros ingresos (ingesta calórica), en otras palabras “comemos poco, gastamos poco” (3). Esto ha llevado a la búsqueda constante de mejores opciones farmacológicas que apoyen los cambios de estilo de vida y que permitan alcanzar objetivos terapéuticos más eficientes y duraderos. Para ello, como ha ocurrido en muchas otras patologías metabólicas (diabetes, hipertensión, dislipidemia), la combinación de fármacos es una opción terapéutica válida también en la obesidad, recordemos la clásica formulación fen-fen (fentermina más fenfluramina) (4), la cual permite un potencial efecto aditivo, complementario o incluso sinergismo entre los fármacos empleados, utilizando además dosis menores con mejores resultados.
Durante éste año 2010 la FDA, ha objetado la aprobación de dos fármacos antiobesidad, el lorcaserín (Lorqess Ò), (un agonista selectivo del receptor serotoninérgico 5HT2c) y la combinación fentermina y topiramato (QnexaÒ), por diferentes efectos adversos, no obstante éste mes de diciembre, ha aprobado inicialmente por 13 votos contra 7, la combinación bupropión-SR y naltrexona-SR (ContraveÒ, Orexigen Therapeutics, Inc.) para el tratamiento de la obesidad, lo que ha renovado la esperanza de una nueva opción terapéutica después del abrupto y cuestionado retiro de la sibutramina.
Investigaciones de las vías centrales que regulan la ingesta energética y peso corporal, identifican principalmente dos sistemas, el sistema melanocortinérgico hipotalámico, el cual integra señales relacionadas al balance energético, produciendo anorexia (5), y el sistema de recompensa mesolímbico, el cual modula la emoción y el placer, por medio de la secreción de dopamina y que ha sido implicado en la conducta adictiva. Estudios anteriores han demostrado que la ingesta de alimentos incrementan la liberación de dopamina en éstos circuitos neuronales, mediando los aspectos placenteros del comer y que la privación crónica de alimentos, disminuye sus concentraciones cerebrales. Por otra parte, se ha señalado que los sujetos obesos tienen una cantidad reducida de receptores cerebrales para dopamina, lo que los conduciría a una sobrealimentación crónica para nivelar sus concentraciones y que contribuiría simultáneamente al desarrollo de su obesidad.
Bupropión y naltrexona. Mecanismos de acción
El bupropión es un inhibidor de la recaptación de dopamina y noradrenalina, que ha sido ampliamente empleado principalmente como antidepresivo y para el abandono del tabaquismo (6,7). El incremento central de ambas aminas neurotransmisoras, actuando sobre el sistema melanocortinérgico, posiblemente explique sus acciones anorexígenas y la reducción de peso observada en obesos en algunos estudios anteriores (8).
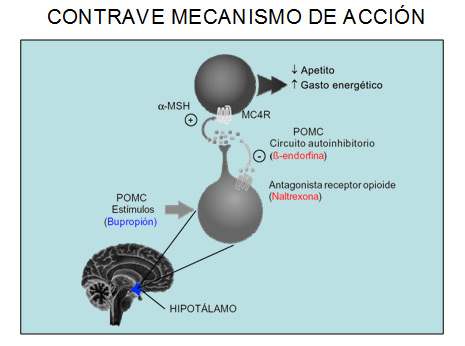
La naltrexona, por su parte, es un antagonista del receptor opiode, aprobada inicialmente para tratar la dependencia opiode y posteriormente para el tratamiento del alcoholismo (9). Si embargo, el uso de naltrexona como monoterapia en humanos ha sido asociada a una mínima reducción de peso corporal (10). Uno de los posibles mecanismos de acción sugerido para la naltrexona, es que ésta participaría antagonizando el normal feedback inhibitorio que limita la acción sostenida del sistema melanocortinérgico ante los estímulos que lo activan. En efecto, en el núcleo arcuato, las neuronas sintetizadoras de POMC (pro-opiomelanocortina) liberan hormona alfa melanocito-estimulante (a-MSH) y b-endorfina, la primera activa el receptor para melanocortina-4 (MC4R) produciendo anorexia, mientras que la segunda inhibiría estas neuronas POMC vía receptores opiodes.
De acuerdo a lo señalado, por tanto la combinación de bupropión y naltrexona conduciría a una potenciación del sistema melanocortinérgico, por una parte el bupropión lo estimularía y la naltrexona permitiría un mayor tiempo de acción de este (Figura 1). Adicionalmente, basados en estudios del uso combinado de bupropión y naltrexona en trastornos adictivos, indicarían que el sinergismo de éstos fármacos en áreas cerebrales dopaminérgicas reducirían la ingesta alimentaria, sugiriendo que el mecanismo de acción de ésta combinación podría también ser mediada por la modulación de las vías de recompensa mesolímbicas (11).
Figura 1
Efectividad y seguridad
Estudios anteriores en sujetos con sobrepeso y obesidad señalan que la combinación de bupropión más naltrexona produce mayores pérdida de peso que con cada una de ellos por separado (12,13). El estudio más reciente publicado con esta combinación fue en agosto de 2010, un estudio de fase III denominado COR-I (The Contrave Obesity Research I) (14). Este se realizó en los EEUU, donde se aleatorizaron alrededor de 1700 adultos obesos (hombres y mujeres, entre 18 y 65 años, IMC entre 30 y 45 kg/m2) para observar la eficacia y seguridad de la combinación farmacológica. Se les administro un tratamiento diario con naltrexona (16 o 32 mg) más bupropión (360 mg), ambos de liberación prolongada o placebo, administrado en 2 tabletas 2 veces al día. Todos los sujetos además fueron instruidos a consumir menos calorías y a ejercitarse más. A las 56 semanas, la pérdida de peso promedio fue mayor con naltrexona-bupropión (5-6% de peso corporal) que con placebo (1%). La terapia combinada también mejoró los resultados secundarios, incluyendo la circunferencia de cintura y triglicéridos. El principal efecto adverso con la combinación fue la náusea (cercano al 30% versus 5% placebo), también se observó cefalea (14% versus 9% placebo), sequedad bucal, constipación, vértigo y vómito, aunque todos ellos en menor frecuencia. Astrup en la editorial acompañando al artículo del COR I, hace notar su preocupación por los posibles efectos adversos de ambos fármacos, en especial el incremento de la presión arterial y frecuencia cardíaca, algo que con anterioridad se había mencionado. Llama la atención que en el grupo de bupropión más naltrexona, que a pesar de la disminución de peso lograda, no se observa claramente un descenso de la presión arterial como era de esperar, incluso la reducción de ella fue menor que la registrada en el grupo placebo (15). Lo anterior es algo que no deja de inquietar y que es necesario tener en consideración en los futuros pacientes tratados con esta posible combinación farmacológica.
Referencias
1.- Schwartz MW, Woods SC, Porte D Jr, et al. Central nervous system control of food intake. Nature 2000;404:661–671.
2.- Blundell JE, Gillett A. Control of food intake in the obese. Obes Res 2001;9 Suppl 4:S263–270.
3.- Valenzuela A. Regulación neuroendocrina de la alimentación. En: Obesidad y sus comorbilidades. Maval Impresores, Santiago, Chile, 2008.
4.- Weintraub M, Hasday JD, Mushlin AI, et al. A double-blind clinical trial in weight control. Use of fenfluramine and phentermine alone and in combination. Arch Intern Med 1984;144:1143-1148.
5.- Cowley MA, Smart JL, Rubinstein M, et al. Leptin activates anorexigenic POMC neurons through a neural network in the arcuate nucleus. Nature 2001;411:480–484.
6.- Ascher JA, Cole JO, Colin JN, et al. Bupropion: a review of its mechanism of antidepressant activity. J Clin Psychiatry 1995;56:395-401.
7.- Foley KF, DeSanty KP, Kast RE. Bupropion: pharmacology and therapeutic applications. Expert Rev Neurother 2006;6:1249-1265.
8.- Anderson JW, Greenway FL, Fujioka K, et al. Bupropion SR enhances weight loss: a 48-week double-blind, placebo-controlled trial. Obes Res 2002;10:633-641.
9.- Bouza C, Angeles M, Munoz A, et al. Efficacy and safety of naltrexone and acamprosate in the treatment of alcohol dependence: a systematic review. Addiction 2004;99:811-828.
10.- Atkinson RL, Berke LK, Drake CR, et al. Effects of long-term therapy with naltrexone on body weight in obesity. Clin Pharmacol Ther 1985;38:419-422.
11.- Sinnayah P, Wallingford NM, Evans AE, et al. Bupropion and naltrexone interact synergistically to decrease food intake in mice. North American Association for the Study of Obesity Annual Scientific Meeting; New Orleans, LA, USA; Oct 20-24, 2007.
12.- Greenway FL, Whitehouse MJ, Guttadauria M, et al. Rational design of a combination medication for the treatment of obesity. Obesity (Silver Spring) 2009; 17:30-39.
13.- Gradman AH, Acevedo C. Evolving strategies for the use of combination therapy in hypertension. Curr Hypertens Rep 2002;4:343-349.
14.- Greenway FL, Fujioka K, Plodkowski RA, et al. Effect of naltrexone plus bupropion on weight loss in overweight and obese adults (COR-I): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2010;376:595-605.
15.- Astrup A. Is cardiometabolic risk improved by weight-loss drugs?. Lancet 2010;376:567-568.
Artículos Anteriores
LORCASERIN : ¿una esperanza menos?
SIBUTRAMINA: En espera de una sentencia definitiva
Rigidez Arterial y Riesgo Vascular
Obesidad: Una mirada más allá de la sobrealimentación y el sedentarismo.
Visfatina: Una puesta al día
Diabetes e Hipogonadismo Hipogonadotrófico